एक्यूट माइलॉयड ल्यूकेमिया (एएमएल)
एक्यूट माइलॉयड ल्यूकेमिया, रक्त कोशिकाओं में होने वाला कैंसर है। अस्थिमज्जा (बोन मैरो) और रक्त प्रवाह में मौजूद कोशिकाओं को रक्त कोशिकाएँ कहा जाता है, और ये निम्नलिखित काम करते हैं: संक्रमणों से लोगों की रक्षा करना और सफेद रक्त कोशिकाओं की मदद से शरीर को इम्यूनिटी प्रदान करना, लाल रक्त कोशिकाओं की सहायता से फेफड़ों से शरीर के सभी हिस्सों में ऑक्सीजन पहुँचाना और प्लेटलेट द्वारा खून के थक्के बनाने में मदद करना। ये सभी रक्त कोशिकाएँ अस्थिमज्जा (बोन मैरो) में स्टेम सेल से शुरू होती हैं। स्टेम सेल आगे माइलॉयड स्टेम सेल और लिम्फॉइड स्टेम सेल में विभाजित होता है। माइलॉयड स्टेम सेल फिर माइलॉयड ब्लास्ट सेल में विभाजित होता है जो आगे न्यूट्रोफिल और मोनोसाइट में विभाजित होता है। माइलॉयड स्टेम सेल से लाल रक्त कोशिकाओं और प्लेटलेट का भी निर्माण होता है। एक्यूट माइलॉयड ल्यूकेमिया, माइलॉयड स्टेम सेल में होने वाला कैंसर है। एएमएल में, ब्लास्ट सेल, अपरिपक्व न्यूट्रोफिल और मोनोसाइट का अत्यधिक उत्पादन होता है।
जब कैंसर बढ़कर अस्थि मज्जा (बोन मैरो) की अधिकांश जगह पर कब्जा कर लेता है, तब यह शरीर में अन्य रक्त कोशिकाओं जैसे कि अन्य सफेद रक्त कोशिकाओं, प्लेटलेट, लाल रक्त कोशिकाओं आदि के उत्पादन को रोक देता है। इससे कैंसर से पैदा होने वाले लक्षण सामने आ जाते हैं। जिससे कैंसर शरीर के अन्य हिस्सों जैसे कि लिम्फ नोड, स्प्लीहा (स्प्लीन) या तंत्रिका तंत्र फैल सकता है।
जहाँ क्रॉनिक माइलॉयड ल्यूकेमिया के विकास की गति धीमी होती है, वहीं एक मरीज में एक्यूट माइलॉयड ल्यूकेमिया (एएमएल) का विकास कुछ दिनों या हफ्तों में देखा जाता है।
एक्यूट माइलॉयड ल्यूकेमिया से बच्चे और वयस्क दोनों ही ग्रस्त हो सकते हैं लेकिन यह वयस्कों में अधिक सामान्य है, विशेष रूप से एएमएल के 40% मामले 75 वर्ष से अधिक उम्र के मरीजों में देखे जाते हैं।
एक्यूट माइलॉयड ल्यूकेमिया को प्रयुक्त विभिन्न वर्गीकरणों के आधार पर अलग-अलग प्रकारों में विभाजित किया गया है। उपयोग किए जाने वाले दो मुख्य वर्गीकरण एफ़एबी वर्गीकरण और डब्ल्यूएचओ वर्गीकरण हैं।
एफ़एबी (फ्रेंच-अमेरिकी-ब्रिटिश) वर्गीकरण
एफ़एबी वर्गीकरण एएमएल को एम1 से एम7 तक 7 सब-टाइप में विभाजित करता है। इन्हें नीचे सूचीबद्ध किया गया है।
एम1- परिपक्वता के बिना एएमएल
एम2- परिपक्वता के साथ एएमएल
एम3- एक्यूट प्रोमाइलोसाइटिक ल्यूकेमिया
एम4- एक्यूट माइलोमोनोसाइटिक ल्यूकेमिया
एम5- एक्यूट मोनोसाइटिक ल्यूकेमिया
एम6- एक्यूट एरिथ्रोल्यूकेमिया
एम7- एक्यूट मेगाकैरीयोब्लास्टिक ल्यूकेमिया
डब्ल्यूएचओ वर्गीकरण
डब्ल्यूएचओ वर्गीकरण इन बिंदुओं पर आधारित है: ल्यूकेमिया सेल टीएटी का प्रकार, ल्यूकेमिया में मौजूद आनुवंशिक परिवर्तन, पिछली कीमोथेरपी की वजह से हुआ एएमएल, और कोई अन्य रक्त स्थिति की विद्यमानता जो एक्यूट ल्यूकेमिया का कारण बन सकती है। यह विस्तृत सूची नहीं है।
एक्यूट माइलॉयड ल्यूकेमिया के विकास से जुड़े जोखिम कारक नीचे दिए गए हैं। इन जोखिम कारकों से एएमएल होने का खतरा बढ़ जाता है।
उम्र
वृद्धावस्था (बड़ी उम्र) भी एएमएल का जोखिम कारक है। एएमएल के लगभग 40% मामले 75 वर्ष से अधिक उम्र के लोगों में होते हैं।
आनुवंशिक (जेनेटिक) स्थितियां
निम्नलिखित आनुवंशिक स्थितियों वाले लोगों में ल्यूकेमिया विकसित होने का जोखिम बढ़ जाता है।
- डाउन्स सिंड्रोम
- ली-फ्रामेनी सिंड्रोम
- ब्लूम सिंड्रोम
- एटैक्सिया तेलंगियाक्टेसिया
- न्यूरोफाइब्रोमैटोसिस टाइप 1
- विस्कॉट-एल्ड्रिच सिंड्रोम
विकिरण (रेडिएशन)
अतीत में विकिरण के उच्च स्तर के संपर्क में आने वाले लोगों में एक्यूट ल्यूकेमिया विकसित होने का जोखिम होता है। एक्यूट लिम्फोब्लास्टिक ल्यूकेमिया की तुलना में एक्यूट माइलॉयड ल्यूकेमिया होने का जोखिम अधिक है। अन्य कैंसर या रोग के लिए पूर्व में हुई रेडियोथेरपी से भी ल्यूकेमिया विकसित होने का जोखिम होता है।
पूर्व में कीमोथेरपी
जिन बच्चों में पहले कोई कीमोथेरपी हुई है, उनमें उपचार के कुछ साल बाद ल्यूकेमिया का जोखिम बढ़ जाता है। यह जोखिम एक्यूट लिम्फोब्लास्टिक ल्यूकेमिया की तुलना में एक्यूट माइलॉयड ल्यूकेमिया के लिए अधिक है।
धूम्रपान
एएमएल के विकास का एक महत्वपूर्ण जोखिम कारक धूम्रपान है। तंबाकू में बेंजीन होता है जो इस जोखिम को बढ़ाता है।
बेंजीन से एक्सपोजर
पेट्रोलियम और रासायनिक उद्योग में काम करने वाले लोगों में साँस के माध्यम से बेंजीन का एक्सपोजर देखा है, जो कि एक्यूट माइलॉयड ल्यूकेमिया के विकास का एक जोखिम कारक है।
रक्त विकार या स्थितियाँ
रक्त के विकार जैसे कि पॉलीसिथेमिया वेरा, मायलोडिसप्लास्टिक सिंड्रोम, मायलोफाइब्रोसिस और क्रॉनिक माइलॉयड ल्यूकेमिया – इन सबसे एएमएल विकसित होने की संभावना हो सकती है।
अधिक वज़न और मोटापा
अधिक वज़न या मोटापे के चलते एएमएल विकसित होने का थोड़ा खतरा बढ़ जाता है।
रक्त, अस्थि मज्जा (बोन मैरो), लिम्फ नोड, यकृत (लीवर), प्लीहा (स्प्लीन) और शरीर के अन्य भागों पर एएमएल के प्रभाव के कारण इसमें विभिन्न प्रकार के लक्षण दिख सकते हैं। इससे जुड़े सामान्य लक्षण नीचे दिए गए हैं। यह ध्यान रखना महत्वपूर्ण है कि ये लक्षण अन्य कारणों से हो सकते हैं, और इन लक्षणों वाले अधिकांश मरीजों में ल्यूकेमिया नहीं होता है।
कमजोरी और थकान
यह एक सामान्य लक्षण है जो इस स्थिति वाले मरीजों में दिखाई देता है। यह एनीमिया (खून की कमी) के चलते हो सकता है क्योंकि इस स्थिति के कारण पर्याप्त मात्रा में लाल रक्त कोशिकाएँ नहीं बन पाती हैं। मरीज ऐसे छोटे काम करने में भी थक जाता है जिसे वो पहले आसानी से कर लेता था।
सांस फूलना
सांस फूलना भी एनीमिया का लक्षण है क्योंकि टिश्यू तक ऑक्सीजन पहुँचाने वाले लाल रक्त कोशिकाओं की संख्या कम होती है। इससे मरीज को सामान्य व्यक्ति की तुलना में वही काम करने के लिए सांस लेने में ज्यादा मेहनत करनी पड़ती है।
बुखार
बुखार, एएमएल का एक सामान्य लक्षण है।
बार-बार संक्रमण
एएमएल के मरीजों की इम्यूनिटी कम हो जाने के कारण वे बार-बार संक्रमण से ग्रस्त हो सकते हैं। ऐसा सामान्य सफेद रक्त कोशिकाओं के कम बनने तथा उन बनी हुई सफेद रक्त कोशिकाओं के क्रियाकलाप में कमी आने के कारण होता है। संक्रमणों से लड़ने में शरीर की क्षमता कम हो जाएगी, और इसलिए मरीज अधिक संक्रमण का अनुभव कर सकते हैं।
रक्तस्राव और चोट
एएमएल से ग्रस्त मरीजों में प्लेटलेट की संख्या कम हो सकती है क्योंकि अस्थि मज्जा (बोन मैरो) में इनका बनना कम हो जाता है और शरीर में ज्यादा संख्या में प्लेटलेट नष्ट होने लगता है। चूँकि प्लेटलेट का काम खून का थक्का बनने में मदद करना है, तो इन कोशिकाओं में कमी आने पर रक्तस्राव की घटना में वृद्धि हो सकती है। मसूड़े, नाक सहित मल-मूत्र आदि त्याग करते समय शरीर में कहीं से भी रक्तस्राव हो सकता है।
लिम्फ नोड में वृद्धि
गर्दन, काँख, छाती, पेट, पेल्विस और ग्रॉइन (यानी पेट और जांघ के बीच के भाग) सहित शरीर के सभी हिस्से में लिम्फ नोड मौजूद होते हैं। इन लिम्फ नोड में वृद्धि एएमएल’ का लक्षण हो सकती है, और इससे इन जगहों पर सूजन आ जाती है। छाती के नोड में वृद्धि होने से खाँसी और सांस फूलने की समस्या महसूस की जा सकती है।
पेट में सूजन और भरा-भरा महसूस होना
एएलएल से ग्रस्त कुछ मरीजों में यकृत (लीवर) और प्लीहा (स्प्लीन) जैसे अंगों में वृद्धि देखी जाती है। दोनों अंग पेट (ऐब्डोमन) में मौजूद होते हैं, और इनमें वृद्धि होने से पेट में जलन या पेट का भरा-भरा होना, दर्द या सांस फूलने की समस्या महसूस होती है।
जब एएमएल का संदेह होता है, तो डायग्नोसिस में सहायता करने और उपचार विकल्पों पर निर्णय लेने के लिए निम्नलिखित परीक्षण किए जाते हैं। इन्हें डॉक्टर द्वारा गहन जाँच के बाद किया जाता है।
ब्लड टेस्ट
रूटीन ब्लड टेस्ट जैसे कि फुल ब्लड काउंट या कम्प्लीट ब्लड पिक्चर से खून में लाल रक्त कोशिकाओं, सफेद रक्त कोशिकाओं और प्लेटलेट की संख्या के बारे में जानकारी मिलेगी। यह खून में मौजूद होने पर ल्यूकेमिया कोशिकाओं की उपस्थिति का भी संकेत दे सकता है। अन्य ब्लड टेस्ट में निम्न शामिल हैं: किडनी फंक्शन या लीवर फंक्शन टेस्ट, रक्तस्राव और खून के थक्के की प्रोफ़ाइल, लैक्टेट डिहाइड्रोजनेज (एलडीएच) और यूरिक एसिड।
फ़्लो साइटोमेट्री
यह एक ऐसी प्रक्रिया है जिसमें रक्त कोशिकाओं को उनके भौतिक और रासायनिक गुणों के आधार पर आगे वर्णित किया जाता है। फ़्लो साइटोमीटर एक ऐसी मशीन है जो लेजर की मदद से खून के नमूने का विश्लेषण करती है। यह कोशिकाओं का पता लगाने के लिए एंटीबॉडी और फ्लोरेसेंस का उपयोग करती है। कोशिकाओं द्वारा उत्पादित विभिन्न फ्लोरेसेंस द्वारा उन कोशिकाओं का नामकरण या विभाजन किया जाता है। इसे कंप्यूटर द्वारा चुना और विश्लेषित किया जाता है। यह एक्यूट माइलॉयड ल्यूकेमिया की डायग्नोसिस करने और विभिन्न प्रकार के एएमएल के सब-टाइप का निर्धारण करने में मदद करता है। मानक माइक्रोस्कोपी की तुलना में फ़्लो साइटोमेट्री अधिक संवेदनशील परीक्षण है, और इसे एएमएल के प्रारंभिक उपचार के बाद उसकी पुनरावृत्ति (रीकरेंस) की डायग्नोसिस करने और पता लगाने में उपयोग किया जाता है।
अस्थि मज्जा (बोन मैरो) परीक्षा

अस्थि मज्जा परीक्षा में हड्डियों से मज्जा (मैरो) का नमूना लिया जाता है, ताकि अस्थि मज्जा में कैंसर कोशिकाओं (एएमएल) और अन्य असामान्यताओं की तलाश की जा सके। इस टेस्ट को आमतौर पर ब्लड और लिम्फेटिक सिस्टम से संबंधित कैंसर में किया जाता है। मज्जा (मैरो) को पेल्विस या उरोस्थि (स्टर्नम) की हड्डियों से लिया जाता है। ऑपरेशन से पहले किसी तरह की दिक्कत को कम करने के लिए लोकल एनेस्थेटिक ड्रग दिया जाता है। इस टेस्ट को बहिरोगी (आउटपेशेंट) आधार पर किया जाता है, और टेस्ट होने के बाद मरीज घर जा सकता है। इसमें दो तरह की जाँच की जाती है। पहला बोन मैरो एस्पिरेशन है जिसमें मज्जा (मैरो) से तरल पदार्थ का नमूना लिया जाता है, और दूसरा ट्रेफिन बायोप्सी है जिसमें हड्डी का एक छोटा सा टुकड़ा भी लिया जाता है। यह रिपोर्ट कुछ दिनों में मिलेगी।
साइटोजेनेटिक्स
बोन मैरो बायोप्सी के नमूनों का परीक्षण कोशिकाओं में जेनेटिक मटेरियल में बदलावों को देखने के लिए भी किया जाता है, जिससे एएमएल के सभी सब-टाइप की डायग्नोसिस करने में मदद मिल सकती है और यह उपचार के बाद रोग के संभावित उपचार विकल्पों एवं परिणामों के बारे में भी सूचित करता है।
इम्यूनोफेनोटाइपिंग और इम्यूनोहिस्टोकेमिस्ट्री
इन परीक्षणों की मदद से एंटीजन और एंटीबॉडी प्रतिक्रियाओं का उपयोग कर कोशिकाओं पर प्रोटीन की तलाश की जाती है ताकि सटीक ढंग से एएमएल वाली कोशिकाओं के स्थान और प्रकार का निर्धारण किया जा सके। कोशिकाओं पर एंटीजन का पता लगाने के लिए इस्तेमाल किए जाने वाले एंटीबॉडी फ्लोरोसेंट होते हैं जो जाँचकर्ता को कोशिकाएँ देखने में सक्षम बनाते हैं।
एफ़आईएसएच (फिश) और पीसीआर
ये डीएनए जाँच द्वारा आनुवंशिक बदलावों का अवलोकन कर ल्यूकेमिया की डायग्नोसिस के लिए किए जाने वाले परीक्षण हैं
लंबर पंचर
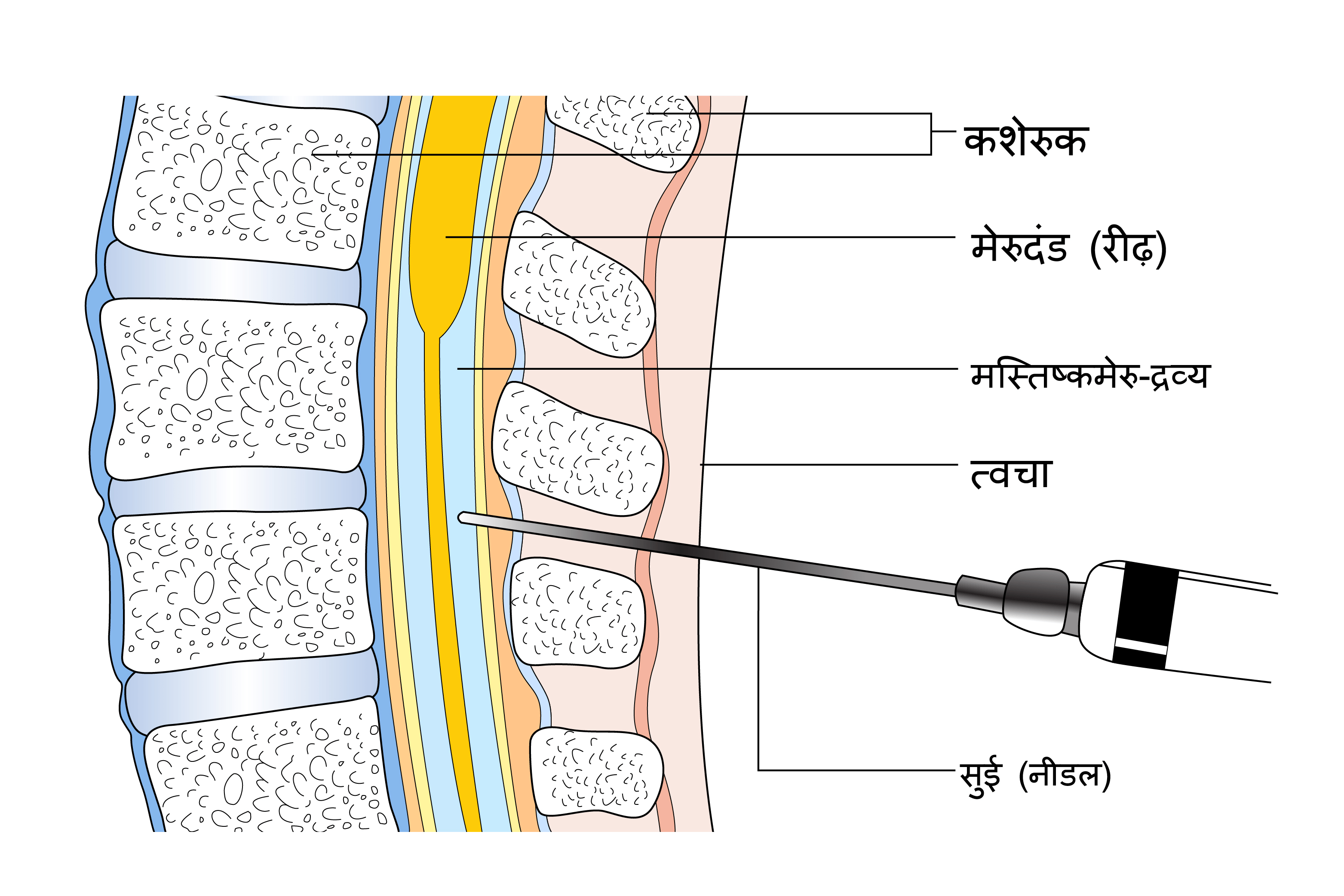
इस परीक्षण में रीढ़ (स्पाइन) में सुई लगाई जाती है ताकि मेरुदंड (स्पाइनल कॉर्ड) के आसपास की जगह में मौजूद तरल पदार्थ का नमूना लेकर वहाँ ल्यूकेमिया कोशिकाओं की उपस्थिति का पता लगाया जा सके। यह परीक्षण मरीज की उम्र के आधार पर लोकल या जनरल एनेस्थेटिक देकर किया जाता है।
सीटी स्कैन
एएमएल से ग्रस्त मरीजों में सीटी स्कैन किया जाता है ताकि बढ़े हुए लिम्फ नोड्स या यकृत (लीवर) और प्लीहा (स्प्लीन) जैसे अंगों का पता लगाया जा सके। इस स्कैन का उद्देश्य गर्दन, छाती, पेट और पेल्विस वाले क्षेत्रों को कवर करना होगा।
एमआरआई स्कैन
मस्तिष्क में कैंसर फैलने का संदेह होने पर, एमआरआई स्कैन पर विचार किया जा सकता है। इस सेटिंग में, सीटी स्कैन की तुलना एमआरआई बेहतर है।
यूएस स्कैन
अगर सीटी स्कैन पर विचार नहीं किया जा रहा है तो यकृत (लीवर) और प्लीहा (स्प्लीन) में वृद्धि देखने के लिए पेट का अल्ट्रासाउंड स्कैन किया जाता है।
एक्यूट माइलॉयड ल्यूकेमिया का उपचार निम्न बातों पर निर्भर करता है: डायग्नोसिस के वक्त कैंसर की अवधि, मरीज की फिटनेस, रोग की सीमा और एएमएल का सब-टाइप। आम तौर पर, उपचार को चरणों में विभाजित किया जा सकता है जो निम्नलिखित हैं: इंडक्शन फेज़, कंसोलिडेशन फेज़ और मेंटनेंस फेज़।
इन तीन फेज़ में इस्तेमाल होने वाली मुख्य उपचार विधि कीमोथेरपी है, जिसमें नस के जरिए दवा दी जाती है। कीमोथेरपी को रीढ़ (स्पाइन) में भी दिया जाता है ताकि रोग-पलटाव (रिलैप्स) रोका जा सके या तंत्रिका तंत्र (नर्वस सिस्टम) में मौजूद होने वाली बीमारी का इलाज़ किया जा सके। उपचार के अन्य प्रकार में शामिल हैं: टार्गेटेड या बायोलॉजिकल थेरपी, रेडियोथेरपी और स्टेम सेल ट्रांसप्लांट। इनके बारे में नीचे बताया जा रहा है।
कीमोथेरपी
इंडक्शन फेज़
कीमोथेरपी के इंडक्शन फेज़ (जिसे रेमिसन इंडक्शन फेज़ भी कहा जाता है) में रोग से पूर्ण छुटकारा पाने के उद्देश्य से दवाओं के संयोजन का उपयोग किया जाता है, जिसमें रक्त या अस्थिमज्जा (बोन मैरो) में कोई भी एएमएल कोशिका शेष नहीं रहती है। इसमें अंतरंग मरीज (इन-पेशेंट) आधार पर उपचार दिया जाता है, और मरीज को कुछ समय (आमतौर पर कुछ हफ्ते) के लिए अस्पताल में रहना पड़ता है ताकि ब्लड काउंट एवं उपचार से होने वाले दुष्प्रभावों (साइड-इफेक्ट) पर नज़र रखी जा सके। इंडक्शन फेज़ में आमतौर पर कीमोथेरपी के रूप में इस्तेमाल की जाने वाली दवाएँ हैं:
मिटोक्सेन्ट्रोन या डॉनोरूबिसिन या इदारूबिसिन के साथ साइटाराबाइन। इन्हें “7+3” उपचार कहा जाता है जहाँ 7 दिनों तक प्रतिदिन साइटाराबाइन दी जाती है और 3 दिनों तक उपरोक्त में से कोई एक दवा दी जाती है।
कुछ प्रकार के एएमएल जैसे कि एफ़एलटी3, आईडीएच1 और आईडीएच2 म्यूटेशन के साथ वाले में भी क्रमशः लक्षित दवाओं जैसे कि मिडोस्टॉरिन, इवोसिडेनिब या एनासाइडेनिब से लाभ हो सकता है।
यह उपचार आमतौर पर काफी गहन होता है और संभावित दुष्प्रभावों में शामिल हैं: थकान, मतली, उल्टी, कब्ज, बालों का झड़ना, स्वाद महसूस न होना और भूख न लगना, दस्त, मुँह में छाले, लो ब्लड काउंट और संक्रमण का जोखिम।
लो ब्लड काउंट वाले मरीजों में, व्हाइट सेल काउंट (ग्रोथ फैक्टर) में सुधार के लिए इंजेक्शन लगाने, ब्लड या प्लेटलेट ट्रांसफ्यूजन की आवश्यकता हो सकती है। उपचार के बाद संक्रमण वाले मरीजों को एंटीबायोटिक्स दिए जाते हैं। लो ब्लड काउंट समय के साथ धीरे-धीरे ठीक हो जाता है।
जो मरीज कम फिट हैं, उनके लिए निम्नलिखित दवाओं के साथ कम गहन इंडक्शन ट्रीटमेंट की योजना बनाई जाती है: अज़ैसिटाडाइन, डेसिटाबाइन, कम डोज़ वाली साइटाराबाइन और जेमटुजुमाब ओजोगेमिसिन। ऑन्कोलॉजिस्ट या हेमेटोलॉजिस्ट मरीज की स्थिति के आधार पर सर्वोत्तम विधि का निर्णय करता है।
कीमोथेरेपी की प्रतिक्रिया के मूल्यांकन के लिए, यदि आवश्यक हो तो 7 दिनों में और फिर से 14 दिनों में बोन मैरो एस्पिरेट और बायोप्सी की जाती है।
कंसोलिडेशन फेज़
कंसोलिडेशन थेरपी (यह भी एक इंटेंसिव कीमोथेरपी है) उन मरीजों में ठीक होने की संभावना बढ़ाने के लिए दी जाती है जिनमें इंडक्शन कीमोथेरपी के बाद रोग में पूरी तरह कमी देखी गई है। कंसोलिडेशन कीमोथेरपी के बिना, एएमएल के दोहराव का जोखिम बहुत अधिक होगा। उपचार के इस चरण में हाई डोज़ वाली साइटाराबाइन (HiDAC), डॉनोरूबिसिन, इदारूबिसिन, मिटोक्सेन्ट्रोन आदि या ऑटोलॉगस/एलोजेनिक स्टेम सेल ट्रांसप्लांट के साथ कीमोथेरपी कोर्स शामिल है। यदि इंडक्शन ट्रीटमेंट के समय लक्षित थेरपी का उपयोग किया गया था, तो इस फेज़ में भी इसे जारी रखा जा सकता है। केवल कीमोथेरपी देनी है या स्टेम सेल ट्रांसप्लांट के बाद कीमोथेरपी देनी है या सीधे स्टेम सेल ट्रांसप्लांट करना है – जैसे उपचारों का चयन कई कारकों पर निर्भर करता है जैसे कि एएमएल का प्रकार, एएमएल में आनुवंशिक परिवर्तन, मरीज की फिटनेस और उपरोक्त फीचर्स के आधार पर रोग की जोखिम प्रोफ़ाइल। मरीजों को अनुकूल प्रोफ़ाइल, मध्यवर्ती जोखिम प्रोफ़ाइल या अत्यधिक जोखिम प्रोफ़ाइल में वर्गीकृत किया जा सकता है, और सबसे उपयुक्त कंसोलिडेशन ट्रीटमेंट के बारे में निर्णय लेते समय इन कारकों को ध्यान में रखा जाएगा।
स्टेम सेल ट्रांसप्लांट
स्टेम सेल ट्रांसप्लांट वह उपचार विधि है जिसका उपयोग एएमएल से ग्रस्त उन मरीजों में किया जा सकता है, जिन्होंने रोग से पूर्ण छुटकारा पा लिया था किंतु उनमें रोग का मध्यवर्ती या उच्च जोखिम प्रोफ़ाइल बना हुआ है, और जिन मरीजों की उम्र 60 वर्ष से कम है। जिन मरीजों में रोग-पलटाव का सामान्य जोखिम होता है, उन्हें स्टेम सेल ट्रांसप्लांट की जरूरत नहीं हो सकती है।
ट्रांसप्लांट करने से पहले, मरीज को कीमोथेरपी की हाई डोज़ दी जाती है, जिसे कंडीशनिंग कीमोथेरपी कहा जाता है। इस कीमोथेरपी का उद्देश्य एएमएल वाली सभी कोशिकाओं को मारना है (माइलोएब्लेटिव कंडीशनिंग)। नॉन-माइलोएब्लेटिव कंडीशनिंग बुजुर्ग या कम फिट मरीजों को दी जाती है, जहाँ कीमोथेरपी कम इंटेंसिव होती है। ट्रांसप्लांट से पहले कंडीशनिंग ट्रीटमेंट के रूप में कीमोथेरपी और रेडियोथेरपी का संयोजन भी उपयोग किया जा सकता है।
अस्थिमज्जा का कार्य सामान्य रूप से रक्त कोशिकाओं का उत्पादन करना है जैसे कि लाल रक्त कोशिकाओं का, जो खून में ऑक्सीजन, (संक्रमण से रक्षा करने वाली) सफेद रक्त कोशिकाएँ और (रक्तस्राव को रोकने में मददगार) प्लेटलेट पहुँचाने में मदद करती हैं। खून में इन कोशिकाओं में उल्लेखनीय कमी होना मरीज के लिए खतरनाक है, और इसलिए हाई डोज़ वाली कीमोथेरपी के बाद इन कोशिकाओं को ट्रांसप्लांट करने की आवश्यकता होती है।
स्टेम सेल का कलेक्शन
स्टेम सेल एक प्रकार की रक्त कोशिकाएँ होती हैं जिनमें किसी भी प्रकार की रक्त कोशिका में विकसित होने की क्षमता होती है जैसे कि लाल रक्त कोशिका, सफेद रक्त कोशिका या प्लेटलेट में। रक्तप्रवाह (ब्लड स्ट्रीम) और अस्थिमज्जा में ये स्टेम सेल मौजूद होते हैं, और इन्हें हाई डोज़ वाली कीमोथेरपी दिए जाने से पहले मरीजों से कलेक्ट किया जाता है। मरीज से स्टेम सेल कलेक्ट करने और हाई डोज़ वाली कीमोथेरपी के बाद इन्हें वापस मरीज में इन्फ्यूज़ (यानी नस में डालना) करने की इस प्रक्रिया को ऑटोलॉगस स्टेम सेल ट्रांसप्लांट कहा जाता है।
यदि स्टेम सेल किसी अन्य व्यक्ति (डोनर) से लिए जाते हैं, तो इस प्रक्रिया को एलोजेनिक स्टेम सेल ट्रांसप्लांट कहा जाता है। डोनर मरीज का रिश्तेदार हो सकता है, आमतौर पर भाई या बहन, या वह रिश्तेदार नहीं भी हो सकता है किंतु उसे आंशिक या पूरी तरह से मिलान वाला डोनर होना चाहिए। यदि कोई डोनर उपलब्ध है तो एएमएल में एलोजेनिक ट्रांसप्लांट को प्राथमिकता दी जाती है।
स्टेम सेल के कलेक्शन से पहले, रक्त में स्टेम सेल की संख्या बढ़ाने के लिए मरीज/डोनर को जी-सीएसएफ़ के साथ इंजेक्शन दिया जा सकता है ताकि सफल कलेक्शन किया जा सके।
स्टेम सेल के कलेक्शन वाले दिन मरीज (ऑटो) या डोनर (एलोजेनिक) को एक मशीन से कनेक्ट किया जाता है, और फिर एक नस से खून निकाल कर मशीन से गुजारा जाता है ताकि खून में मौजूद स्टेम सेल को कलेक्ट किया जा सके। फिर, वह खून एक दूसरी नस के जरिए मरीज/डोनर में वापस पहुँचता है। यह प्रक्रिया कुछ घंटों में पूरी होती है।
स्टेम सेल कलेक्ट होने के बाद, मरीज को हाई डोज़ वाली कीमोथेरपी दी जाती है। कीमोथेरपी के बाद, स्टेम सेल को मरीज में इन्फ्यूज़ किया जाता है। ये कोशिकाएँ अस्थिमज्जा में जाकर फिर से रक्त कोशिकाएँ बनाने लगती हैं।
अस्थिमज्जा (बोन मैरो) का कलेक्शन
अस्थिमज्जा, हड्डियों के अंदर मौजूद एक स्पंजी मटेरियल है। अस्थिमज्जा (बोन मैरो) ट्रांसप्लांट के लिए, हाई डोज़ वाली कीमोथेरपी देने से पहले मज्जा (मैरो) कलेक्ट करने की आवश्यकता होती है। मज्जा (मैरो) कलेक्ट करने की प्रक्रिया आमतौर पर ऑपरेशन थियेटर में सामान्य एनेस्थेसिया देकर की जाती है। मज्जा (मैरो) को हड्डियों में अलग-अलग जगहों से निकाला जा सकता है, और प्रक्रिया के दौरान यह लगभग 1 लीटर निकाला जा सकता है। इसे निकालने के बाद स्टोर किया जाता है और जरूरत पड़ने पर मरीज में इंफ्यूज किया जाता है।
स्टेम सेल ट्रांसप्लांट के जोखिम और दुष्प्रभाव
स्टेम सेल या बोन मैरो ट्रांसप्लांट एक जटिल प्रक्रिया है और इसके दुष्प्रभाव देखे जाते हैं। इस प्रक्रिया में आमतौर पर कुछ हफ्तों तक अस्पताल में रहना पड़ता है ताकि ट्रांसप्लांट के बाद मज्जा और रक्त में मौजूद रक्त कोशिकाएँ अपने सामान्य स्तर पर आ जाएँ। इस प्रक्रिया से जुड़े सामान्य दुष्प्रभावों में शामिल हैं:
मतली, उल्टी, बालों का झड़ना, लीवर के क्रियाकलाप में बदलाव – इस उपचार के संभावित दुष्प्रभाव हैं।
संक्रमण का जोखिम क्योंकि सफेद रक्त कोशिकाओं की संख्या कम हो जाती है, और मरीज को संक्रमण होने का खतरा रहता है। संक्रमण बैक्टीरियल, वायरल या फंगल हो सकते हैं, और आमतौर पर उन्हें नियंत्रित करने के लिए एंटीबायोटिक दवाएँ देने आवश्यकता होगी।
कीमोथेरपी का एक दुष्प्रभाव म्यूकोसाइटिस भी है जिसमें मुँह और पाचन तंत्र की भीतर की परत में दरारें आ जाती हैं। इसके चलते मरीज को मुँह से भोजन लेने में दिक्कत हो सकती है, और तब शरीर में आहार पहुँचाने के लिए अन्य तरीकों का उपयोग किया जा सकता है।
प्लेटलेट काउंट कम होने के चलते इस प्रक्रिया में रक्तस्राव का जोखिम भी देखा जाता है, लेकिन प्लेटलेट काउंट को अपेक्षित स्तर पर बनाए रखने के लिए प्लेटलेट ट्रांसफ्यूजन दिया जा सकता है।
ग्राफ्ट वर्सेस होस्ट डिजीज (जीवीएचडी), ट्रांसफ्यूज्ड कोशिकाओं के प्रति शरीर की प्रतिक्रिया है, खास तौर पर अगर मरीज को डोनर से स्टेम सेल या मज्जा (मैरो) मिला है।
रेडियोथेरपी
स्टेम सेल ट्रांसप्लांट से पहले कंडीशनिंग ट्रीटमेंट के रूप में भी रेडियोथेरपी इस्तेमाल की जा सकती है। कंडीशनिंग ट्रीटमेंट वह विधि है जिसमें उपचार का लक्ष्य स्टेम सेल ट्रांसप्लांट से पहले शरीर की सभी रक्त कोशिकाओं से छुटकारा पाना है। यह कंडीशनिंग ट्रीटमेंट कीमोथेरपी या रेडियोथेरपी हो सकती है। जब रेडियोथेरेपी का उपयोग किया जाता है, तो इसे पूरे शरीर पर दिया जाता है और इसे टोटल बॉडी इरेडिएशन (टीबीआई) कहा जाता है। टीबीआई ट्रीटमेंट के दुष्प्रभावों में निम्न शामिल हैं: थकान, नींद न आना, बालों का झड़ना, दस्त, मुँह में छाले, लो ब्लड काउंट और संक्रमण का जोखिम, रक्तस्राव, मतली और उल्टी।
पुनरावर्ती (रिलैप्स्ड) या अवशिष्ट (रेसिड्युअल) रोग का उपचार
इंडक्शन और कंसोलिडेशन ट्रीटमेंट द्वारा काफी सारे मरीजों की स्थिति में सुधार देखा जा सकता है। कुछ मरीजों का अन्य दवाओं से इलाज किया जाएगा और कुछ का नहीं। ऐसे कुछ मरीज जिनकी बीमारी उपरोक्त उपचार के बाद ठीक हो गई थी, उनमें कुछ समय बाद फिर से रोग का उभार संभव है। इन मरीजों के लिए उपचार विकल्प में स्टेम सेल ट्रांसप्लांट के बाद अधिक कीमोथेरपी दी जा सकती है यदि उपचार के बाद उनके रोग में फिर से आंशिक या पूरी तरह कमी आई है।
ग्राफ्ट वर्सेस होस्ट डिजीज, स्टेम सेल या बोन मैरो ट्रांसप्लांटेशन से होने वाली जटिलता है। यह डोनर की उन कोशिकाओं (टी कोशिकाओं) के बीच एक प्रतिक्रिया है जिसे मरीज और मरीज के शरीर में ट्रांसफ्यूज किया गया है। टी कोशिकाएँ होस्ट (मरीज) की कोशिकाओं को बाहरी मानकर उन पर प्रतिक्रिया करती हैं। त्वचा, आंत और यकृत (लीवर) इस स्थिति से सबसे ज्यादा प्रभावित अंग हैं। जीवीएचडी, एलोजेनिक ट्रांसप्लांट वाले मरीजों में होता है जहाँ कोशिकाओं को किसी अन्य व्यक्ति से प्रत्यारोपित किया जाता है। अगर मरीज के साथ ट्रांसप्लांट डोनर का निकट संबंध है, और डोनर एवं मरीज के बीच अच्छा मिलान हुआ है तो इस जटिलता का खतरा कम है। अगर डोनर संबंधी नहीं है या डोनर एवं मरीज के बीच आंशिक रूप से मिलान हुआ है तो जोखिम अधिक होता है।
जीवीएचडी दो प्रकार के हो सकते हैं- एक्यूट और क्रॉनिक। जीवीएचडी को इसकी गंभीरता के अनुसार भी वर्गीकृत किया जा सकता है।
ग्रेड 1- मरीज में हल्के लक्षण होते हैं
ग्रेड 2- मध्यम लक्षण
ग्रेड 3- गंभीर लक्षण
ग्रेड 4- बहुत गंभीर लक्षण
एक्यूट जीवीएचडी में ट्रांसप्लांट के पहले 100 दिनों में जटिलता देखी जाती है, लेकिन यह आमतौर पर ट्रांसप्लांट से 2-3 सप्ताह बाद होता है। एक्यूट जीवीएचडी के लक्षणों में त्वचा पर चकत्ते होना शामिल हैं जिनमें खुजलाहट और पीड़ा हो सकती है। अन्य लक्षणों में दस्त, भूख न लगना, उल्टी और पीलिया (पांडु रोग) शामिल हैं।
क्रॉनिक जीवीएचडी, ट्रांसप्लांट के 100 दिनों बाद होता है और इसके लक्षणों में शामिल है: त्वचा पर चकत्ते जिनमें खुजली होती है, त्वचा का बदरंग होना, दस्त, मुँह सूखना, पीलिया और लीवर में जख्म। यह फेफड़ों को प्रभावित कर सकता है जिससे खाँसी और साँस फूलने की समस्या पैदा होती है, इसके अलावा, आँखों में सूखापन और दर्द, मांसपेशियों में दर्द महसूस हो सकता है।
मरीज के लक्षणों और डॉक्टर द्वारा जाँच के निष्कर्षों के आधार पर जीवीएचडी की डायग्नोसिस की जाती है। इसकी उपस्थिति की पुष्टि करने के लिए त्वचा, लीवर या अन्य जगहों की बायोप्सी की जाती है।
जीवीएचडी का उपचार और रोकथाम मुख्य रूप से डोनर और होस्ट कोशिकाओं के बीच प्रतिक्रिया को कम करने के लिए इम्यून सिस्टम को सप्रेस कर किया जाता है। इसमें मदद के लिए दवाओं का उपयोग किया जाता है। आमतौर पर इस्तेमाल होने वाली दवाओं में शामिल हैं: इन्फ्लिक्सिमैब, एटेनरसेप्ट, मायकोफेनोलेट मोफेटिल (एमएमएफ), सिरोलिमस, टैक्रोलिमस, रिटक्सिमैब, इब्रुटिनब, अजैथियोप्रिन और पेंटोस्टैटिन। रोग नियंत्रण में मदद के लिए सामान्य सहायक उपचार जैसे कि दर्दनाशक (पेन किलर्स), उल्टी, दस्त रोकने की दवाएँ, संक्रमण कम या ठीक करने की दवाएँ, आँखों के सूखापन के लिए कृत्रिम आँसू, न्यूट्रिशनल और फ्लूइड सपोर्ट तथा अन्य उपाय अपनाए जाते हैं। क्रॉनिक जीवीएचडी वाले मरीजों में ऐसे लक्षण हो सकते हैं जो लंबे समय तक मौजूद रहते हैं, इसलिए त्वचा, लीवर, फेफड़े, आंखों, योनि के लिए सहायक उपाय जारी रखे जाते हैं। आवश्यक सावधानियाँ





