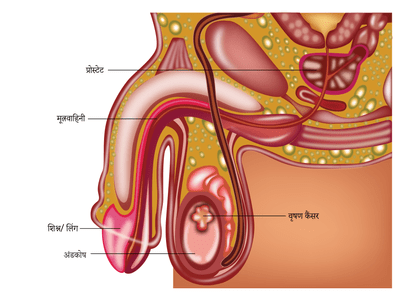
वृषण
वृषण या अंडकोष पुरुष प्रजनन अंग हैं। पुरुष में दाएं और बाएं दो वृषण यानि अंडे होते हैं जो अंडकोष में स्थित होते हैं। वृषणकोश लिंग के नीचे स्थित होता है। वृषण एक हार्मोन का उत्पादन करता है जिसे टेस्टोस्टेरोन कहा जाता है। टेस्टोस्टेरोन पुरुष विशेषताओं जैसे चेहरे और शरीर के बालों की वृद्धि, गहरी आवाज और मांसपेशियों के विकास में सक्षम बनाता है। वृषण शुक्राणु का उत्पादन भी करते हैं। वृषण में उत्पन्न होने वाले शुक्राणु को एपिडीडिमिस और शुक्राणु कॉर्ड नामक नली के माध्यम से मूत्रमार्ग में स्थानांतरित किया जाता है।
वृषण कैंसर
वृषण में शुरू होने वाले कैंसर को वृषण कैंसर कहा जाता है। वृषण कैंसर के दो मुख्य प्रकार सेमिनोमा और गैर-सेमिनोमा हैं। इन्हें रोगाणु कोशिका ट्यूमर भी कहा जाता है। वृषण के कैंसर के असामान्य रूपों में लिम्फोमा और एडेनोकार्सिनोमा जैसे अन्य परा वृषण कैंसर शामिल हैं।
25 वर्ष की आयु से युवा लोगों में वृषण कैंसर आम बात है। यह 25-35 वर्ष की आयु के पुरुषों में कैंसर का सबसे सामान्य रूप हैं। 55 से 65 वर्ष की आयु के वृद्ध पुरुषों में भी वृषण कैंसर हो सकता है। ग्लोबोकेन 2018 के आंकड़ों के अनुसार, भारत में 4414 वृषण कैंसर के मामले थे, जो सभी कैंसरों का लगभग 0.4% है।
वृषण कैंसर कई प्रकार के हो सकते हैं और नीचे सूचीबद्ध हैं। वृषण कैंसर के अधिकांश रोगाणु कोशिका ट्यूमर होते हैं। ये कैंसर या सुदम्य (बिनाइन) ट्यूमर हो सकते हैं।
जनन कोशिका (जर्म सेल) ट्यूमर को विभिन्न श्रेणियों में विभाजित किया जा सकता है और इसमें शामिल हैं
- सेमिनोमा
- टेराटोमा
- मिश्रित जनन कोशिका ट्यूमर
- शुक्राणुकोशिका सेमिनोमा
टेराटोमा को परिपक्व टेराटोमा, अपरिपक्व टेराटोमा, भ्रूण कार्सिनोमा या योल्क सैक ट्यूमर में वर्गीकृत किया जा सकता है। एक ट्यूमर में इन प्रतिस्थापनों का मिश्रण हो सकता है।
वृषण में होने वाले गैर-जनन कोशिका ट्यूमर असामान्य हैं और इसमें शामिल हो सकते हैं
- सार्कोमा
- लिम्फोमा
- सेक्स कॉर्ड / लेडिग सेल ट्यूमर
वृषण कैंसर कुछ जोखिम कारकों से जुड़ा होता है जो इस तरह के कैंसर होने का जोखिम बढ़ाते हैं। इनमें शामिल है:
अप्रकट वृषण
उन लोगों में वृषण कैंसर का खतरा अधिक होता है, जिनके पास बिना अप्रकट वृषण है। यह एक ऐसी स्थिति है जहां वृषण जन्म के समय या बाद में अंडकोश में पूरी तरह से नहीं उतरे हैं। इस जोखिम को कम किया जाता है यदि 2 वर्ष की आयु तक अप्रकट वृषणों का सर्जिकल सुधार किया जाता है।
परिवारिक इतिहास
वृषण कैंसर के पारिवारिक इतिहास वाले मरीजों में कैंसर होने का जोखिम कम होता है। लगभग 2% वृषण कैंसर पारिवारिक इतिहास वाले जैसे कि पिता, भाई आदि के रोगियों में होते हैं।
आनुवंशिक स्थितियां
आनुवंशिक स्थितियों जैसे कि क्लाइनफेल्टर के सिंड्रोम, डॉन के सिंड्रोम वाले रोगियों में अधिक जोखिम होता है। इन रोगियों में वृषण के असामान्य विकास के कारण इसके होने की संभावना है।
वृषण कैंसर कई तरह से दिखाई दे सकते हैं और सामान्य रूप से दिखाई देने वाले लक्षण नीचे दिए गए हैं।
वृषण में गांठ या सूजन
यह दिखाई देने वाला एक बहुत ही सामान्य लक्षण है। वृषण में एक गांठ की भावना जो आकार में धीरे-धीरे बढ़ रही है। गांठ दर्द रहित या दर्दनाक हो सकता है और आमतौर पर वृषण से अलग नहीं होती है। कभी-कभी, गांठ होने से पहले वृषण में किसी मार का इतिहास होता है।
गांठ छोटी या बड़ी हो सकती है और वृषण में अधिकांश गांठ कैंसर नहीं है। हालांकि यह महत्वपूर्ण है कि डॉक्टर द्वारा गांठ की जांच की जाए।
वृषण या अंडकोश में दर्द
यह भी वृषण कैंसर के लिए एक लक्षण हो सकता है। पुन:, केवल दर्दनाक वृषण वाले रोगियों के केवल एक छोटे से अनुपात में कैंसर होता है।
अन्य लक्षण
वृषण कैंसर में देखे जा सकने वाले अन्य असामान्य लक्षणों में पैरों में सूजन, खांसी, सांस फूलना, पेट में सूजन, वजन में कमी, बांझपन, गर्दन में गांठ या निगलने में कठिनाई शामिल है। ये लक्षण वृषण से छाती या पेट के क्षेत्रों तक कैंसर फैलने के कारण होते हैं।
वृषण कैंसर का संदेह होने पर निम्नलिखित जांचों पर विचार किया जाता है।
वृषणकोश का अल्ट्रासाउंड
वृषणों और वृषणकोश का अल्ट्रासाउंड स्कैन यह निर्धारित करने में सक्षम होगा कि वृषण में गांठ ठोस है या द्रव से भरा है। जिन गांठों में तरल पदार्थ होता है उनमें कैंसर होने की संभावना कम होती है। स्कैन यह भी बताता है कि वृषणकोश में गांठ वृषण से है या वृषणकोश में अन्य क्षेत्रों से है।
रक्त परीक्षण
ट्यूमर मार्कर रक्त परीक्षण होते हैं जो कैंसर की उपस्थिति की जांच करने के लिए किए जाते हैं। ट्यूमर मार्करों को कुछ वृषण कैंसर में उठाया जा सकता है और इसलिए ये परीक्षण उन सभी रोगियों में किए जाते हैं जिन्हें इस तरह के कैंसर होने का संदेह होता है। आमतौर पर मापा जाने वाला ट्यूमर मार्कर अल्फा फीटो प्रोटीन (AFP), बी ह्यूमन कोरियोनिक गोनाडोट्रॉफिन (b HCG) और LDH हैं। ट्यूमर मार्करों के अलावा, यकृत, गुर्दे की क्रिया का आकलन करने के लिए नियमित रक्त परीक्षण किये जाते हैं।
वृषणोच्छेदन (ऑर्किडेक्टोमी)
वृषणोच्छेदन (ऑर्किडेक्टोमी) एक सर्जिकल ऑपरेशन है जहां वृषण को निकाल दिया जाता है। यह तब किया जाता है जब नैदानिक जांच के साथ-साथ उपरोक्त जांच एक वृषण कैंसर की मौजूदगी दर्शाती है।
इस कैंसर का संदेह होने पर आमतौर पर बायोप्सी नहीं की जाती है क्योंकि इससे कैंसर फैलने का खतरा बढ़ सकता है और इसलिए बिना बायोप्सी के सर्जरी की जाती है। ऑपरेशन में, एक प्रोस्थेसिस (झूठा वृषण) को निकाले गए वृषण के स्थान में रखा जा सकता है।
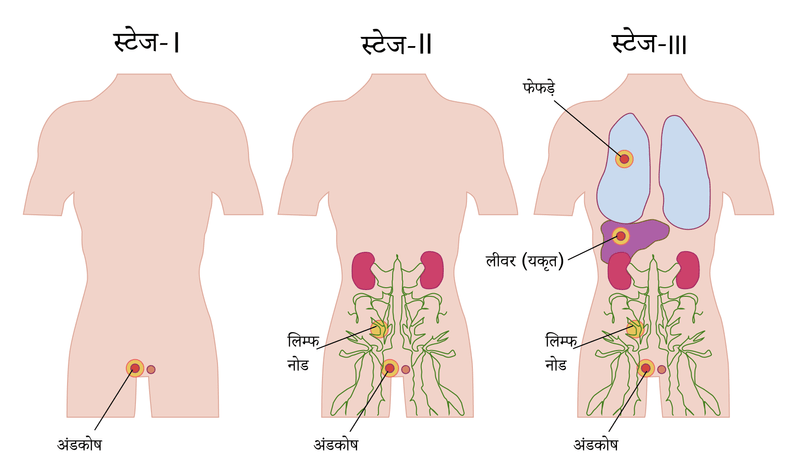
निदान के बाद स्टेज-निर्णारण परीक्षण किए जाते हैं
स्टेज-निर्धारण से तात्पर्य एक ऐसी प्रक्रिया से है जो यह पता लगाने में सहायता करती है कि कैंसर अपने उद्गम स्थल से शरीर के अन्य भागों में फैला है या नहीं।
छाती का एक्स – रे
छाती में कैंसर के फैलाव को देखने के लिए छाती का एक्स-रे लिया जाता है।
सीटी स्कैन
विपर्यास व्यतिरेक (कन्ट्रैस्ट) के साथ छाती, पेट और श्रोणि (पेल्विस) का सीटी स्कैन ऐसे मरीज के स्टेज का निर्धारण करने के लिए किया जाता है जिसे उन्नत वृषण कैंसर होने का संदेह होता है। स्कैन इस बारे में जानकारी देगा कि कैंसर शरीर में अन्य क्षेत्रों में फैल गया है या नहीं और यह निर्धारित करता है कि वृषणोच्छेदन (ऑर्किडेक्टोमी) के बाद आगे के उपचार की आवश्यकता है या नहीं।
पीईटी सीटी स्कैन
आमतौर पर वृषण कैंसर के प्रारंभिक स्टेज के लिए पीईटी सीटी स्कैन की सिफारिश नहीं की जाती है, लेकिन ऐसी स्थितियों में उपयोगी होती है जब शरीर के अन्य हिस्सों में कैंसर के फैलने की चिंता होती है।
वृषण कैंसर के स्टेज का निर्धारण TNM और नंबर स्टेजिंग सिस्टम द्वारा किया जाता है और नीचे सूचीबद्ध किये गए हैं। यहां स्टेजिंग के निर्धारण के लिए ट्यूमर मार्कर के स्तर का भी उपयोग किया जाता है।
T स्टेज
| T1 | ट्यूमर लिम्फोविस्कुलर प्रसार के बिना वृषण तक ही सीमित होता है |
| T1a | आकार में 3 सेमी से छोटा ट्यूमर |
| T1b | आकार में 3 सेमी या उससे बड़ा ट्यूमर |
| T2 | ट्यूमर लिम्फोविस्कुलर प्रसार के साथ वृषण तक सीमित है या वृषण के आस-पास के ऊतकों पर हमला करने वाला ट्यूमर |
| T3 | ट्यूमर लिम्फोविस्कुलर प्रसार के साथ या बिना शुक्राणु कॉर्ड पर हमला करता है |
| T4 | ट्यूमर लिम्फोविस्कुलर प्रसार के साथ या बिना शुक्राणु कॉर्ड पर हमला करता है |
N स्टेज क्लिनिकल N या पैथोलॉजिकल N हो सकता है यह इस बात पर निर्भर करता है कि स्टेजिंग क्लिनिकल तरीकों से की गई थी या सर्जरी के बाद की गई थी।
क्लिनिकल N
| cN0 | कोई क्षेत्रीय लिम्फ नोड मेटास्टेसिस नहीं |
| cN1 | एक या कई लिम्फ नोडों में मेटास्टेस आकार में 2cm से अधिक नहीं |
| cN2 | एक लिम्फ नोड में या बहु नोड्स में मेटास्टेसिस आकार में 2 सेमी से अधिक और आकार में 5 सेमी से कम |
| cN3 | आकार में 5 सेमी से बड़े लिम्फ नोड द्रव्यमान के साथ मेटास्टेसिस |
पैथोलॉजिकल N
| pN0 | कोई लिम्फ नोड मेटास्टेसिस नहीं |
| pN1 | एक या बहु लिम्फ नोडों में मेटास्टेस आकार में 2cm से अधिक नहीं, बहु नोड्स 5 से अधिक नहीं. |
| pN2 | एक लिम्फ नोड में या बहु नोड्स में मेटास्टेसिस आकार में 2 सेमी से अधिक और आकार में 5 सेमी से कम, अथवा 5 से अधिक नोड या लिम्फ नोड्स के बाहर रोग का विस्तार |
| pN3 | आकार में 5 सेमी से बड़े लिम्फ नोड द्रव्यमान के साथ मेटास्टेसिस |
मेटास्टेसिस (M)
| M0 | कोई दूरस्थ मेटास्टेस नहीं |
| M1 | दूरस्थ मेटास्टेस दिखाई दिए |
सीरम मार्कर (S)
S2LDH 1.5-10 x N या B-hCG (mIU/mL) 5000-50,000 या AFP (ng/mL) 1000-
10,000S3LDH >10 x N याr B-hCG (mIU/mL) >50,000 या AFP (ng/mL) >10,000
| S0 | ट्यूमर मार्कर का स्तर सामान्य सीमाओं के भीतर |
| S1 | LDH <1.5 x N और B-hCG (mIU/mL) <5000 और AFP (ng/mL) <1000 |
नंबर स्टेजिंग सिस्टम निम्नलिखित है :
स्टेज 1 कैंसर
स्टेज 1 कैंसर वह होता है जब कैंसर वृषण तक सीमित है और वृषण के बाहर नहीं फैला है। वृषणोच्छेदन (ऑर्किडेक्टोमी) के बाद ट्यूमर मार्कर ऊंचा रहता है या नहीं, इसके आधार पर हर स्टेज को एक ‘S’ दिया जाता है। यदि ट्यूमर मार्कर ऊंचा हो जाते हैं, तो यह स्टेज 1S होगा।
स्टेज 2 कैंसर
स्टेज 2 कैंसर वह होता है, जिसमें वृषण से कैंसर का प्रसार श्रोणि या पेट के लिम्फ नोड्स में हो जाता है। स्टेज 2 को फिर से 2A, 2B और 2C में विभाजित किया जा सकता है जो इस बात पर निर्भर करता है कि ऊपर N स्टेजिंग क्रमशः N1, N2 और N3 है।
स्टेज 3 कैंसर
स्टेज 3 कैंसर तब होता है जब पेट के परे लिम्फ नोड का जुड़ाव है या कैंसर में अन्य अंगों का जुड़ाव है अथवा S2 और S3 श्रेणी में ट्यूमर मार्करों का उच्च स्तर होता है।
वृषण कैंसरों का उपचार सर्जरी, कीमोथेरेपी और रेडियोथेरेपी के विकल्पों के साथ किया जाता है।
सर्जनी
वृषणोच्छेदन (ऑर्किडेक्टोमी)
वृषण कैंसर के सर्जिकल प्रबंधन में कैंसरग्रस्त पूरे वृषण को हटाना शामिल है और इस प्रक्रिया को ऑर्किक्टोमी या ऑर्किडेक्टोमी कहा जाता है। यहाँ वृषण को हटाने के लिए कमर क्षेत्र में चीरा लगाया जाता है। सर्जरी के समय, हटाए गए वृषण के स्थान पर एक कृत्रिम अंग (प्रोस्थेसिस) लगाया जा सकता है। प्रारंभिक वृषण कैंसर में, वृषणोच्छेदन (ऑर्किडेक्टोमी) एकमात्र ऑपरेशन है जिसकी आवश्यकता होती है।
लिम्फ नोड विच्छेदन
कुछ देशों में, वृषण के बाहर कोई बीमारी दिखाई न देने पर वृषणोच्छेदन (ऑर्किडेक्टोमी) एकमात्र ऑपरेशन है। अन्य देशों में, वृषणोच्छेदन (ऑर्किडेक्टोमी) और पेट के लिए लिम्फ नोड को हटाने का काम किया जाता है। आपका डॉक्टर बताएगा कि किस ऑपरेशन की योजना है।
पेट में बढ़े हुए लिम्फ नोड्स वाले रोगियों में जो किमोथेरेपी या रेडियोथेरेपी के बाद आकार में कम नहीं होते हैं, लिम्फ नोड्स के सर्जिकल हटाने पर विचार किया जा सकता है।
इस प्रक्रिया को रेट्रोपरिटोनियल लिम्फ नोड विच्छेदन के रूप में कहा जाता है और उन रोगियों में इसकी आवश्यकता नहीं होती है जिनमें शुरुआती वृषण कैंसर होते हैं या जिनके उपचार के बाद लिम्फ नोड्स बढ़े नहीं होते हैं।
अन्य क्षेत्र
कभी- कभी शरीर में अन्य क्षेत्रों से कीमोथेरेपी या रेडियोथेरेपी से कम नहीं हुए लिम्फ नोड द्रव्यमान को हटाने के लिए सर्जरी की जाती है।
कैंसर के स्टेज के आधार पर सर्जरी के बाद कीमोथेरेपी या रेडियोथेरेपी जैसे अन्य उपचार की आवश्यकता हो सकती है और इस पर उनके संबंधित अध्यायों में चर्चा की गई है।
कीमोथेरेपी
कीमोथेरेपी आमतौर पर वृषण कैंसर के प्रबंधन में प्रयोग किया जाता है। यहां कीमोथेरेपी का उद्देश्य बीमारी को नियंत्रित करना और ठीक करना है। कीमोथेरेपी की आवश्यकता और उपयोग की जाने वाली दवाओं का चुनाव वृषण कैंसर के प्रकार और निदान में कैंसर के स्टेज पर निर्भर करता है।
सेमिनोमा
कीमोथेरेपी का उपयोग सेमिनोमा के उपचार में किया जाता है। आमतौर पर सेमिनोमा में इस्तेमाल की जाने वाली दवाओं में कार्बोप्लाटिन, EP या BEP कीमोथेरेपी विधान शामिल हैं। BEP विधान में ब्लेमाइसिन, ईटोपोसाइड और सिस्प्लैटिन शामिल हैं। चुनी गई औषधि सेमिनोमा के स्टेज और रोगी की सामान्य स्थिति और पसन्दों पर निर्भर करता है। प्रारंभिक स्टेज के सेमिनोमा में, सर्जरी के बाद कीमोथेरेपी पर विचार किया जाता है और उन्नत चरणों में, कीमोथेरेपी को पहले उपचार के रूप में इस्तेमाल किया जा सकता है।
गैर-सेमिनोमा कैंसर
सेमिनोमा के अलावा अन्य कैंसर को गैर सेमिनोमैटस जर्म सेल ट्यूमर कहा जाता है। इन ट्यूमरों के उपचार के विकल्प निदान पर कैंसर के स्टेज पर निर्भर करते हैं। प्रारंभिक कैंसर में, कीमोथेरेपी के उपयोग की आवश्यकता नहीं होती है और केवल सर्जरी ही पर्याप्त होती है, जहाँ अधिक उन्नत कैंसर में कीमोथेरेपी का उपयोग निश्चित रूप से किया जाता है। यहाँ आमतौर पर इस्तेमाल की जाने वाली कीमोथेरेपी विकल्प BEP है जैसा कि ऊपर वर्णित है। आमतौर पर 4 चक्र दिए जाते हैं।
वृषण कैंसर के लिए रेडियोथेरेपी
रेडियोथेरेपी का उपयोग कतिपय वृषण कैंसरों के इलाज के लिए किया जाता है। यह उपचार सर्जरी के पूरा होने के बाद दिया जाता है।
सेमिनोमा
रेडियोथेरेपी का उपयोग स्टेज 1 और 2 सेमिनोमा में उपचार के विकल्प के रूप में किया जा सकता है। वृषण कैंसर में, आमतौर पर सर्जरी के बाद प्रारंभिक अवस्था में कीमोथेरेपी या रेडियोथेरेपी का उपयोग करने का विकल्प होता है क्योंकि दोनों विकल्प स्थिति को ठीक करने में मदद कर सकते हैं। निर्णय लेने से पहले डॉक्टर के साथ विकल्पों पर चर्चा की जा सकती है।
गैर सेमिनोमा कैंसर
गैर सेमिनोमेटस जर्म सेल ट्यूमर के उपचार के लिए आमतौर पर रेडियोथेरेपी पर विचार नहीं किया जाता है। यहां सर्जरी के बाद कीमोथेरेपी उपचार का पसंदीदा विकल्प है।
सेमिनोमा का उपचार
सेमिनोमा के उपचार का निर्धारण निदान पर स्टेज के आधार पर किया जाता है। सेमिनोमा का निदान किए गए अधिकांश रोगियों का आमतौर पर उपचार में पहले चरण के रूप में एक वृषणोच्छेदन (ऑर्किडेक्टोमी) किया जाता है। यह लिम्फ नोड विच्छेदन के साथ या इसके बिना हो सकता है। आगे का उपचार मुख्य रूप से स्टेज द्वारा निर्धारित किया जाता है।
स्टेज 1 सेमिनोमा
स्टेज 1 सेमिनोमा एक अत्यधिक साध्य रोग है और सर्जरी के बाद आगे का इलाज हमेशा आवश्यक नहीं है। उपचार के विकल्प के रूप में निम्नलिखित विकल्पों पर विचार किया जाता है।
निगरानी एक ऐसा विकल्प है जहां सर्जरी के बाद कोई और उपचार नहीं दिया जाता है और मरीज को नियमित रूप से क्लिनिक में देखा जाता है। यह छाती के एक्स-रे और सीटी स्कैन के साथ आमतौर पर पहले दो वर्षों में अक्सर प्रत्येक 1-2 महीने तक होता है और उसके बाद आवृत्ति कम हो जाती है। यह विकल्प नीचे वर्णित विकल्पों जितना ही अच्छा है जो मरीज को डॉक्टर के नियमित विजिट की योजना बनाने में सहायक होता है।
कीमोथेरेपी कार्बोप्लाटिन के 1 चक्र के साथ कैंसर के इस स्टेज में उपचार का एक और विकल्प है। यहां कार्बोप्लाटिन कीमोथेरेपी की एक खुराक मरीज को दी जाती है। इस कीमोथेरेपी के संभावित दुष्प्रभावों में युवा मरीजों में प्रजनन क्षमता पर प्रभाव, कम ब्लड काउंट और संक्रमण, मतली और उल्टी, कब्ज और थकान का जोखिम शामिल है।
रेडियोथेरेपी इस स्टेज में उपचार का एक और विकल्प है। उपचार परा-महाधमनी लिम्फ नोड क्षेत्र को लक्षित करने के लिए है और 10 दिनों की अवधि के लिए है और संभावित दुष्प्रभावों में थकावट, कम प्रजनन क्षमता के छोटे जोखिम शामिल हैं।
कौन सा विकल्प चुना जाए, यह इन उपचारों के गुण व दोष, मरीज की आयु और मरीज की इच्छाओं पर निर्भर करेगा।
स्टेज 2 सेमिनोमा
स्टेज 2 सेमिनोमा के मरीजों का उनकी सर्जरी के बाद रेडियोथेरेपी या कीमोथेरेपी के साथ इलाज किया जा सकता है। किस स्टेज में बीमारी है, इसके आधार पर, कीमोथेरेपी एकल एजेंट कार्बोप्लाटिन के साथ हो सकती है या ईटोपोसाइड और सिस्प्लैटिन या कार्बोप्लाटिन के साथ संयोजन कीमोथेरेपी हो सकती है। स्टेज 1 में वर्णित एकल एजेंट कार्बोप्लाटिन को रेडियोथेरेपी के साथ जोड़ा जा सकता है।
स्टेज 3 और 4 सेमिनोमा
स्टेज 3 सेमिनोमा वाले मरीजों का उपचार संयोजन कीमोथेरेपी के साथ किया जाता है।
टेराटोमा या गैर- सेमिनोमैटस जर्म सेल ट्यूमरों का उपचार
इन ट्यूमरों वाले मरीजों का सर्जरी के बाद कीमोथेरेपी के साथ इलाज किया जाता है जो सर्जरी के समय रोग के स्टेज और सर्जरी के बाद को सर्जरी के बाद B-HCG, AFP और LDH जैसे ट्यूमर मार्करों के स्तर पर निर्भर करता है।
स्टेज 1 टेराटोमा
स्टेज 1 टेराटोमा वाले मरीजों का सर्जरी के बाद पैथोलॉजी नमूने में देखे गए वाहिकामय प्रसार की उपस्थिति या अनुपस्थिति के आधार पर निगरानी या कीमोथेरेपी के साथ इलाज किया जा सकता है। वाहिकामय प्रसार की अनुपस्थिति में, स्टेज 1 ट्यूमर को कीमोथेरेपी के बजाय केवल निगरानी और गहन फालो-अप की आवश्यकता हो सकती है। वाहिकामय प्रसार वाले मरीजों को BEP विधान के साथ कीमोथेरेपी के 2 चक्रों से लाभ होगा। BEP में ब्लेओमाइसिन, सिस्प्लैटिन और ईटोपोसाइड दवाएं शामिल हैं। यह प्रत्येक 3 सप्ताह में 5 दिनों के लिए दिया जाता है। रेट्रोपेरिटोनियल लिम्फ नोड सर्जरी या निगरानी के साथ सर्जिकल स्टेजिंग भी विकल्प हैं
मेटास्टैटिक टेराटोमा
उन्नत टेराटोमा वाले मरीजों को आमतौर पर BEP विधान के साथ संयोजन कीमोथेरेपी से इलाज किया जाता है। यह 3 या 4 चक्रों के लिए है, प्रत्येक चक्र 21 दिनों तक चलता है। प्रत्येक चक्र में कीमोथेरेपी 5 दिनों के लिए दी जाती है और इसे 3 दिन (3 दिन BEP) पर भी दिया जा सकता है। इस कीमोथेरेपी से ये ट्यूमर बहुत ही साध्य हैं। कीमोथेरेपी के विषाक्तता या साइड इफेक्ट्स में थकावट, बालों का झड़ना, कम ब्लड काउंट, संक्रमण का खतरा, उल्टी, पतली टट्टी, प्रजनन क्षमता में कमी, फेफड़ों को नुकसान शामिल है।
पुनरावर्ती या प्रत्यावर्ती या प्रतिरोधी रोग
सेमिनोमा या टेराटोमा के मरीजों के लिए, जिनका रोग प्रारंभिक उपचार से ठीक नहीं हुआ है, या जिनके रोग की पुनरावृत्ति हुई है, उनका VIP या TIP जैसे कीमोथेरेपी विधानों से इलाज किया जाता है। स्टेम सेल समर्थन के साथ कीमोथेरेपी की उच्च खुराक पर भी विचार किया जाता है।
ब्लेओमाइसिन फेफड़े की विषाक्तता
ब्लेओमाइसिन BEP कीमोथेरेपी विधान का हिस्सा है। यह दवा कुछ रोगियों में फेफड़ों को दीर्घकालिक नुकसान पहुंचा सकती है और इसलिए इस उपचार के दौरान फेफड़े की क्रिया की बारीकी से निगरानी की जानी चाहिए। ब्लेओमाइसिन विषाक्तता से जुड़े लक्षणों में सूखी खाँसी और सांस की तकलीफ शामिल है। साथ ही, यह दवा उन मरीजों को नहीं दी जाती है जिन्हें पहले से ही फेफड़े की बीमारी है या धूम्रपान करने वाले हैं।
शुक्राणु बैंकिंग
वृषण कैंसर के लिए कीमोथेरेपी और रेडियोथेरेपी करवाने वाले युवा पुरुषों के लिए, शुक्राणु बैंकिंग की सलाह दी जाती है क्योंकि बांझपन एक दुष्प्रभाव हो सकता है, विशेष रूप से कीमोथेरेपी के मामले में। शुक्राणु बैंकिंग एक ऐसी प्रक्रिया है जिसमें रोगी के शुक्राणु को कीमोथेरेपी प्राप्त करने से पहले संग्रहीत किया जाता है।





